Bohr menyusun teori berdasarkan spektrum atom hidrogen, yaitu:
- Berharga 1, 2, 3, 4 …..
- Menunjukkan besarnya lintasan elektron
- Menunjukkan di subkulit (sublintasan) mana elektron bergerak dan juga menentukan bentuk orbital
Bentuk orbital bergantung pada bilangan kuantum azimut (l), artinya orbital dengan bilangan kuantum azimut sama mempunyai bentuk yang sama.Orientasi orbital terkait dengan bilangan kuantum magnetik.
a. Orbital di subkulit s

b. Orbital di subkulit p

c. Orbital di subkulit d

5. KONFIGURASI ELEKTRON
Perhatikan contoh penulisan konfigurasi elektron dari beberapa atom berikut!
a. Elektron bergerak mengelilingi inti atom pada lintasan-lintasan tertentu yang berbentuk lingkaran,
b. Elektron dapat berpindah dari lintasan satu ke lintasan lain dengan menyerap atau memancarkan sejumlah energi.
2. TEORI ATOM MEKANIKA KUANTUM
Dicetuskan oleh Schrodinger yang mengatakan bahwa atom mempunyai inti bermuatan positif dan elektron bermuatan negatif yang mengelilingi inti.
Dicetuskan oleh Schrodinger yang mengatakan bahwa atom mempunyai inti bermuatan positif dan elektron bermuatan negatif yang mengelilingi inti.
3. BILANGAN KUANTUM
Agar elektron-elektron dapat dibedakan satu dengan yang lain, maka
diberikan empat bilangan kuantum untuk setiap elektron.
a. Bilangan kuantum utama (n)diberikan empat bilangan kuantum untuk setiap elektron.
- Berharga 1, 2, 3, 4 …..
- Menunjukkan besarnya lintasan elektron
b. Bilangan kuantum azimut (l)
- Berharga 0, 1, 2, 3, ….. (n - 1)- Menunjukkan di subkulit (sublintasan) mana elektron bergerak dan juga menentukan bentuk orbital
c. Bilangan kuantum magnetik (m)
- Berharga -l, ….0,…, +l
- Menentukan kedudukan atau orientasi orbital
d. Bilangan kuantum spin (s)
- Berharga dan +1/2 dan -1/2
- Harga s memberikan gambaran tentang arah perputaran electron
. BENTUK DAN ORIENTASI ORBITAL- Berharga -l, ….0,…, +l
- Menentukan kedudukan atau orientasi orbital
d. Bilangan kuantum spin (s)
- Berharga dan +1/2 dan -1/2
- Harga s memberikan gambaran tentang arah perputaran electron
Bentuk orbital bergantung pada bilangan kuantum azimut (l), artinya orbital dengan bilangan kuantum azimut sama mempunyai bentuk yang sama.Orientasi orbital terkait dengan bilangan kuantum magnetik.
a. Orbital di subkulit s

b. Orbital di subkulit p

c. Orbital di subkulit d

5. KONFIGURASI ELEKTRON
Konfigurasi elektron menggambarkan lokasi semua elektron menurut orbital-orbital yang ditempati.
Dalam menulis konfigurasi elektron mengikuti aturan-aturan :
a. Prinsip Aufbau: Elektron akan mengisi orbital atom yang tingkat energi relatifnya lebih rendah dahulu baru orbital atom yang tingkat energi relatifnya lebih tinggi .
Urutan tingkat energi : 1s 2s 2p 3s 3p 4s 3d
Dalam menulis konfigurasi elektron mengikuti aturan-aturan :
a. Prinsip Aufbau: Elektron akan mengisi orbital atom yang tingkat energi relatifnya lebih rendah dahulu baru orbital atom yang tingkat energi relatifnya lebih tinggi .
Urutan tingkat energi : 1s 2s 2p 3s 3p 4s 3d

Perhatikan contoh penulisan konfigurasi elektron dari beberapa atom berikut!
1s22s22p1
 1s22s22p63s1
1s22s22p63s1
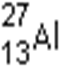 1s22s22p63s23p1
1s22s22p63s23p1
 1s22s22p63s23p64s1
1s22s22p63s23p64s1
 1s22s22p63s23p64s23d1
1s22s22p63s23p64s23d1
 1s22s22p63s23p64s23d104p1
1s22s22p63s23p64s23d104p1
b. Larangan Pauli: Tidak mungkin ada dua elektron dengan keempat bilangan-bilangan kuantum sama, setiap orbital dapat diisi oleh maksimal 2 elektron
 1s22s22p63s1
1s22s22p63s1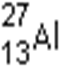 1s22s22p63s23p1
1s22s22p63s23p1 1s22s22p63s23p64s1
1s22s22p63s23p64s1 1s22s22p63s23p64s23d1
1s22s22p63s23p64s23d1 1s22s22p63s23p64s23d104p1
1s22s22p63s23p64s23d104p1b. Larangan Pauli: Tidak mungkin ada dua elektron dengan keempat bilangan-bilangan kuantum sama, setiap orbital dapat diisi oleh maksimal 2 elektron
c. Aturan Hund pada pengisian orbital-orbital setingkat, elektron-elektron tidak
membentuk pasangan lebih dahulu sebelum masing-masing orbital setingkat
terisi sebuah elektron
Contoh: Konfigurasi elektron
membentuk pasangan lebih dahulu sebelum masing-masing orbital setingkat
terisi sebuah elektron
Contoh: Konfigurasi elektron
Untuk menuliskan konfigurasi electron dapat dilakukan dengan cara sebagai berikut :
1) Penulisan Urutan Subkulit
Contoh : Penulisan konfigurasi electron Ni (Z=28)
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d8 (sesuai urutan tingkat energinya)b) 1s2 2s2 2p6 3s2 3p6 3d8 4s2
(sesuai kenaikan bilangan kuantum)
2) Penulisan dengan Konfigurasi Elektron Gas Mulia
Contoh : Penulisan Konfigurasi Elektron Ca (Z=20) yaitu :
(sesuai kenaikan bilangan kuantum)
2) Penulisan dengan Konfigurasi Elektron Gas Mulia
Contoh : Penulisan Konfigurasi Elektron Ca (Z=20) yaitu :
20 Ca = 1s2 2s2 2p6 3s2 3p6 4s2
Konfigurasi electron Ca dapat dituliskan :
20Ca = [ Ar ] 4s2
3) Penulisan Konfigurasi Elektron Ion
Contoh :
19K = 1s2 2s2 2p6 3s2 3p6 4s1
K+ = 1s2 2s2 2p6 3s2 3p6 (melepas satu electron terluar)
17Cl = 1s2 2s2 2p6 3s2 3p5
Cl- = 1s2 2s2 2p6 3s2 3p6 ( menerima satu elektron )
4) Subkulit d Cenderung Penuh (d10) atau ½ Penuh (d5)
Aturan Aufbau,,,,,,,,,,,,,,,,,,,,menurut percobaan
24Cr = [Ar] 3d4 4s2,,,,,,,,,,,,,,,,,,,,,,,,,[Ar] 3d5 4s1




Share your views...
0 Respones to "Struktur Atom II"
Posting Komentar